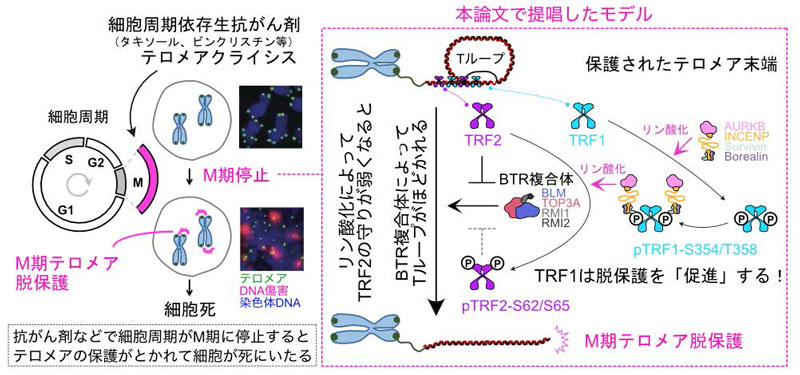
染色体の端にはテロメアという構造があり、遺伝情報を守るバリアのような役割を果たしています。タキソールやビンクリスチンといった殺細胞性の抗がん剤を使って細胞の細胞周期を有糸分裂(M)期に停止させると、テロメアの保護が解けて細胞死のシグナルとなる現象「M期テロメア脱保護」が知られていましたが、その分子メカニズムはよくわかっていませんでした。
林眞理 医学研究科客員准教授(兼:イタリア分子癌研究所(AIRC Institute of Molecular Oncology:IFOM ETS)グループリーダー)、Diana Romero-Zamora 同研究員(現:沖縄科学技術大学院大学博士研究員)、Samuel Rogers オーストラリア・小児医学研究所(Children's Medical Research Institute)研究員(現:ファイザー・オーストラリア(Pfizer Australia)シニアマネージャー)、Anthony J. Cesare 同グループリーダー(兼:オーストラリア・シドニー大学(University of Sydney)教授)らの国際共同研究グループは、M期停止中にテロメアに局在する因子の探索から、BTR(BLM-TOP3A-RMI1-RMI2)という酵素複合体がテロメア脱保護を促進することを発見しました。さらに、オーロラキナーゼB(AURKB)がテロメア結合因子TRF1およびTRF2をリン酸化することが脱保護促進に必須であることを見出しました。この成果は、殺細胞性抗がん剤の薬理効果を理解するうえで重要な知見を提供し、治療法の改善や開発につながることが期待されます。
本研究成果は、2025年3月17日に、国際学術誌「Nature Communications」にオンライン掲載されました。
【DOI】
https://doi.org/10.1038/s41467-025-57456-8
【KURENAIアクセスURL】
http://hdl.handle.net/2433/292674
【書誌情報】
Diana Romero-Zamora, Samuel Rogers, Ronnie Ren Jie Low, Scott G. Page, Blake J. E. Lane, Shunya Kosaka, Andrew B. Robinson, Lucy French, Noa Lamm, Fuyuki Ishikawa, Makoto T. Hayashi, Anthony J. Cesare (2025). A CPC-shelterin-BTR axis regulates mitotic telomere deprotection. Nature Communications, 16, 2277.





