2009年1月5日
三木邦夫教授(京都大学大学院理学研究科)らの研究グループは、ペルオキシソーム(真核生物において酸化反応をつかさどる細胞小器官)のタンパク質輸送に関与するPexタンパク質群のなかで、中核を担う重要なタンパク質であるPex14pの分子構造を世界で初めて解明しました。この研究成果が、米国科学誌「米国化学アカデミー紀要(PNAS)」誌12月29日-1月2日の週の電子版に掲載されました。
1.背景
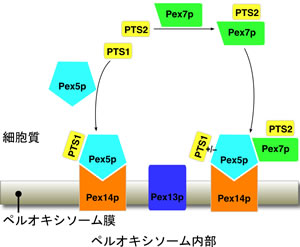
図1 ペルオキシソームにおけるタンパク質輸送
ペルオキシソームは、真核生物に見られる細胞小器官で、脂質膜から構成され、内部では極長鎖脂肪酸のβ-酸化やリン脂質の合成など多くの重要な代謝機能が行われています。また、致死性の遺伝性疾患をもたらすことから、生体機能にとって不可欠な細胞小器官として知られています。ペルオキシソームで働くタンパク質は細胞質で合成され、Pexタンパク質群(Pex1~Pex26)によりペルオキシソーム内部に輸送されます。輸送されるタンパク質は、2種類あるペルオキシソーム移行シグナル(PTS1、PTS2)のいずれかを持っています。PTS1やPex7pと結合したPTS2はいずれもPex5pに結合し、そのPex5pがさらにペルオキシソーム膜に存在するPex14pに結合することでペルオキシソーム内部に輸送されます。(図1)。
Pex14pは、N末端の保存ドメイン、膜貫通ドメイン、コイルドコイルドメインから構成される複雑なタンパク質です(図2)。N末端にある保存ドメインはPex5pのWxxxF/Yモチーフと結合します。また、この部分は、Pex19pやPex13pとの相互作用部位としても働きます。つまり、Pex14pはPexタンパク質群が集合して構成するタンパク質輸送装置において中心的役割を担う重要なタンパク質なのです。これまでの研究の結果、保存ドメインが他のPexタンパク質との相互作用に関与していることが示唆されていましたが、立体構造がわからなかったために、さらなる研究が展開できない状況でした。
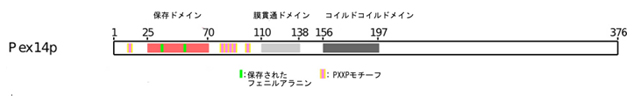
図2 Pex14pのドメイン構造
2.研究手法と成果
研究グループでは、ペルオキシソームにおけるタンパク質輸送の分子レベルでのメカニズムの解明をめざして、ラット由来のPex14pを研究対象に、その保存ドメインについてタンパク質分解酵素による切断実験や円二色性スペクトル測定を始めとするさまざまな生化学的実験を行いました。その結果、Pex5pに対する結合能を維持したまま安定に結晶化に使用することのできる変異体(Pex14p(25-70))を作成することができ、結晶作成に成功しました。さらには、大型放射光施設SPring-8の構造生物学用ビームライン(BL41XU、BL44B2)を用いて、X線回折強度データを収集して構造解析を行った結果、1.8Å分解能という非常に高い精度で解析することに成功しました。
構造解析の結果、この保存ドメインが三本のへリックスから構成されていることが分かりました(図3)。また、分子の片側に保存性の残基によって疎水性の表面が形成されていました。さまざまな生物種で完全に保存している二つのフェニルアラニン残基(Phe35とPhe52)がこの疎水性表面の中央部に突き出しており、正電荷を持った残基のかたまり(Lys34、Arg40、Lys55およびLys56)とともに、他のPexタンパク質との相互作用部位を形成していることが分かりました(図4)。αへリックス構造をもつPex5pのWxxxF/Yモチーフに存在する2つの芳香族アミノ酸(トリプトファンとフェニルアラニン/チロシン)はちょうどこの結合部位にすっぽりと収まります(図5)。この場合、二つのタンパク質間には、π―π相互作用とカチオン―π相互作用が形成されます。実際、Pex14pのフェニルアラニンを変異させるとPex5pとの結合能がなくなり、ペルオキシソームタンパク質輸送に異常が確認されました。
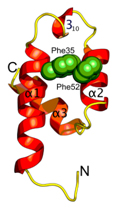 図3 Pex14p(25-70)の結晶構造 | 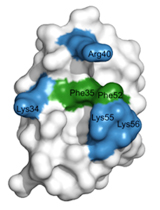 図4 Pex14p(25-70)の分子表面 | 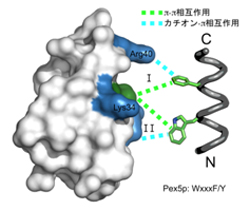 図5 Pex5pのWxxxF/Yモチーフとの相互作用 |
3.今後の展開
タンパク質の輸送は、細菌類から高等生物に至るまで幅広く見られる現象であり、その仕組みを分子のレベルで明らかにしていくことは、生命の本質にせまるために非常に重要な作業です。今回の研究成果をもとに今後、Pex14pと他のPexタンパク質との複合体(Pex14p-Pex5p複合体やPex14p-Pex13p-Pex5p複合体)のX線結晶構造解析を進めていく予定で、それらの構造が明らかになることによって、タンパク質がペルオキシソームに運ばれる仕組みが、より詳しく解明されることになります。また、ペルオキシソームにおけるタンパク質輸送は、ペルオキシソームの形成やその異常による疾患に密接に関連していることから、今回決定した立体構造をもとにして、ペルオキシソーム形成異常疾患の発症機構が解明されることが期待されます。
- 京都新聞(12月31日 3面)に掲載されました。

